摘要: 本文探讨了中药新药的人用经验应用思路和中药新药申报与创新问题。结合澳大利亚古方来源中 成药品种情况、澳大利亚登记类药品管理、日本汉方制剂品种情况、日本非处方药管理模式进行汇总分 析。应用人用经验的重点在于不同风险程度和不同表述方式所对应的适应证需提供不同等级的临床研究 证据。不同风险中药新药适应证可选择不同的表述方式,不同的表述方式可考虑按对应体系的临床评价 标准来进行评估。需重视做好中药新药传承与创新的政策平衡,建议在给予具有人用经验的中药注册申 请政策优惠的同时,考虑给经实验优化的中药获批上市后销售上的利好。
2019年发布的《关于促进中医药 传承创新发展的意见》强调"加快构建中医药理论、 人用经验和临床试验相结合的中药注册审评证据体系, 优化基于古代经典名方、名老中医方、医疗机构制剂等具有人用经验的中药新药审评技术要求,加快中药 新药审批”。本文总结出应用人用经验的相关考虑, 对澳大利亚古方来源中成药品种情况、澳大利亚登记 类药品管理、日本汉方制剂品种情况、日本非处方药(OTC) 管理模式的研究心得进行汇总分析,并对中 药注册申请进行拓展思考,提出“适应证分类管理模 式"供参考,探讨中药非处方药申报思路,并对临床 评价难点—— 无特定适应证的证候类中药或民族药进 行思考。
1 人用经验应用的相关思考
人用经验如何应用,国内外尚无成熟的应用模式, 因此,人用经验的应用是政策制订的难点之一。目前, 关于人用经验应用的相关文件正在起草制订中。本文 就相关问题进行了思考,通过对澳大利亚登记类药品 管理、日本非处方药 (OTC) 管理模式的研究心得进行 汇总分析,总结出人用经验应用的适用范围、基本要 求、临床研究证据要求以及相关申报建议,以供探讨。
1.1 中药新药审评审批政策研究思路
中药新药审评审批政策的总体思路为借鉴境外中 药/植物药审评审批政策的有益经验,获得注册监管、 技术要求、品种信息,综合分析得到有针对性的建议。
1.1.1 研究范围的考虑因素 确定境外中药/植物药审 评审批相关的政策研究点,考虑的因素包括:①在境 外以药品身份上市销售;②药用物质来源于中药/草 药/植物等天然物质。以这两个因素作为研究对象的选 择依据,考虑重点研究两个国家植物药的管理情况和 技术要求,包括日本汉方制剂和澳大利亚登记药品。
1.1.2 日本汉方制剂 日本汉方制剂有两种管理模式:
一是适应证分类管理2(对适应证进行分类,规定每 类适应证可用的生药),二是品种目录管理3(类似于 经典名方100首)。日本汉方制剂以品种目录管理的模 式为主,同名称品种不同厂家产品之间的处方量、提 取物量、适应证表述、日服提取物量、日服饮片量等 均存在差异。
1.1.3 澳大利亚登记药品/经评估登记药品 澳大利亚药品管理局 (Therapeutic Goods Administration,TGA) 对临床研究证据进行等级划分[含随机对照试验、比 较研究(非对照)、观察性研究(队列研究、病例对照 研究)、文献等],并按风险程度划分出高风险、中风险、低风险适应证l56, 不同风险程度的适应证提供不 同等级的证据。澳大利亚获批的中成药,同名称品种不 同厂家产品之间也存在和汉方药类似的差异。
① 澳大利亚登记药品的管理模式:制订“许可成 分清单” (含药材、化学成分、酶类等),“许可适应 证清单”8(均为低风险适应证)。在两个清单范围内 的药品,提供证据后即可上市,不一定需要提供申请 人的研究数据。
② 澳大利亚经评估登记药品适应证9:应包含一 个中风险适应证,并要求提供高质量的研究数据,含 非临床药效学和临床研究数据。澳大利亚经评估登记 药品的仿制药或新药上市路径,含有中药可申报的路 径,可为同名同方药,以及中药非处方药上市注册的 可能情形之一—— 同名同方的已上市中药非处方药的 上市申报提供参考。
1.2 人用经验的适用范围
古方加减方、临床经验方、名老中医方、医疗机构 中药制剂这四种来源的中药新药均具有临床使用经验。 其中医疗机构中药制剂在处方、工艺、用法用量、适应 证等方面比较明确和固定,并且相对于其他三种以个 别医师为主用药的情况,医疗机构中药制剂的应用范 围较广,可在医院内使用,或医院间调剂使用。因此应 用人用经验进行申报资料减免的政策,建议从医疗机 构中药制剂开展调研,为应用人用经验提供参考。
1.3 人用经验的基本要求
在日服处方量、处方药味及药味用量比例、制备 工艺、剂型、用法用量、适应证等方面,需提供充分 证据证明人用经验与拟申报新药的一致性。除汤剂可 制成颗粒剂外,其余剂型应当与既往临床应用一致。
1.4 人用经验的临床研究证据要求
应用人用经验的重点在于不同风险程度和不同表 述方式所对应的适应证需提供不同等级的临床研究证 据。结合对澳大利亚经评估登记类药品的管理模式, 对应用人用经验需提供的临床研究证据整理如下,详 见表1及表2。

从高到低临床研究证据来源的层次为:系统评价、 多中心随机对照试验、小型随机对照试验、比较研究(非 对照)、观察性研究(队列研究、病例对照研究)、非系 统的广义评价(包括数据库)、《中国药典》、 SCI 文献。
1.5 人用经验的申报建议
定位于高风险适应证的具人用经验的中药新药建 议简化申报,即申报资料建议免药效学试验,不免2 期临床;定位于中风险适应证的具人用经验的中药新药建议申报资料免药效学试验,视情况免2期临床; 定位于低风险适应证的具人用经验的中药新药可考虑 备案形式。

、
2 关于中药新药申报的拓展思考
为了更好地鼓励中药的创新发展,可考虑新增中药 非处方药的申报方式,并针对无特定适应证的证候类中 药或民族药临床评价的难点寻找改善措施,结合对澳大 利亚登记类药品、日本非处方药的注册管理模式的研究 情况,提出以下建议。
2.1 不同风险中药新药的适应证表述及临床评价标准 建议
通过对澳大利亚治疗用品管理局 (TGA) 官网提 供的澳大利亚治疗用品注册簿 (ARTG) 数 据 库 [ 以 及我国的药智数据库 进行检索,梳理澳大利亚古方 来源中成药、日本汉方制剂的同名称不同获批产品的 药品概要或说明书信息,结果见表3。
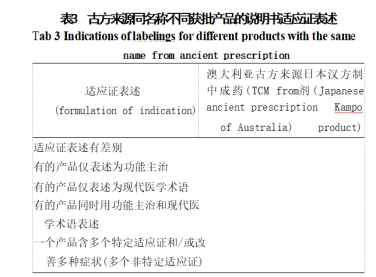
根据表3结果,对不同风险中药新药的适应证表 述有以下建议:高风险适应证仅以现代医学术语表述, 或同时用功能主治和现代医学术语表述;中、低风险 适应证表述可仅为功能主治,或仅为现代医学术语表 述,或同时用功能主治和现代医学术语表述。由申请 人决定适合的表述方式,并提供符合要求的人用经验 证据。根据申请人选择的不同表述方式,按对应体系 的临床评价标准进行评估。
2.2 适应证分类管理模式
可考虑划分出若干中风险适应证/功能主治范围,并制订每个适应证/功能主治范围内许可使用的药材清 单。例如列出若干个适应证范围,每个适应证范围下细 分若干适应证,并为每个适应证列出许可的药材清单, 可根据中医理论或传统医药理论进行自由组方。适应 证/功能主治的入选依据可参考我国古代名方的古代和 现代适应证/功能主治,每个适应证/功能主治范围所 对应药材的入选依据可根据古代名方的古代和现代处 方药味的使用情况进行考虑。在确定了适应证/功能主 治范围及其对应的药材清单的基础上,根据申报资料 的简化程度,再考虑是否对处方药味用量比例、日服用 量、制备工艺、剂型等进行限定。
2.3 中药非处方药申报建议
如考虑增加中药非处方药申报,适用的情况包 括:①具有人用经验,定位于中、低风险适应证的中 药。即定位于中风险适应证的具人用经验中药,建议 简化申报,即申报资料减免(免药效学试验,视情况 免2期临床);定位于低风险适应证的具人用经验中药, 也可考虑备案形式。②适应证分类管理范围内的,定 位于中风险适应证的中药。
2.4 无特定适应证的证候类中药或民族药申报建议
无特定适应证的证候类中药或民族药在评估上存 在一定困难,为鼓励该类新药的研发,可考虑的申报 思路为:①具有人用经验中药/民族药的简化申报或 考虑备案形式;②适应证分类管理形式。
3 中药新药传承与创新的政策平衡
对于中药新药的传承和创新,有两种建议: 一种 是尊重临床经验,保持与人用经验的一致性,不通过 实验研究追求优质处方、优秀制法、好的药效,享受 减免药效或临床试验的政策利好;另一种是遵循中 医药发展规律,将临床经验与药学实验研究结合,进 行中药新药的研发、预测、评价、择优。可考虑的研 究方法举例12-16:以药效活性成分作为质量控制指标 (Q-marker), 建立标准制剂控制模式,采用定量指纹 图谱技术进行研发。具体措施包括:①采用处方均匀 设计法(要求用药总量不变),以动物的药效实验结果 为参考,采用偏相关回归分析法,找到每个药味与考 察的药效指标的相关系数大小;②依据各药味的药效 作用指标大小重新设计处方量,在第二次处方的药效 实验结果基础上筛选出好的药效、好的工艺,优化处 方,在保持总药效作用不变情况下尽可能降低日服用 量;③通过总结和研究谱效关系,创建中药标准制剂 的控制模式,实现药效物质量值传递的系统化控制。
对于第1种尊重临床经验的情况,技术要求及申 报资料要求如放得过宽,可能不利于中药创新发展。 第二种结合实验研究的研发方式,可能采用更多的新 工艺、新技术创新中药,对于中药科研成果的转化、 中药品质的提升、中药价值的提高、中药产业的健康 发展有积极意义。中药新药的相关政策制订,需在给 予尊重临床经验的中药注册申请政策优惠的同时,考 虑给经实验优化的中药获批上市后销售上的利好,例如,如果经实验优化的中药新药是在现代医药理论指 导下使用,其适应证用现代医学术语表述,则属于天 然药物新药,又可称为“基于中药提取的天然药物”。 从理论上理解,天然药物新药在开具处方上不应受限 于中医医师。
4 结语
守正创新,不是守着传统文化不变,而是重在文 化更新;不是以传统经验替代现代知识,而是以传统 经验辅以现代技术知识,根据现代需要,用科学方法, 学习和实践古人的有益教诲,这是当前做好中药守正 创新不可推卸的历史责任。中药事业的发展没有现成 模式可以参考,中药与西药互为补充,只有采用多元 化的思维方式,构建多层次、多形式的中药发展理念, 才能开创中药发展新局面。
